|

 |
|  | |||||||||||||||||||||||||||||||||||||||||||||||||
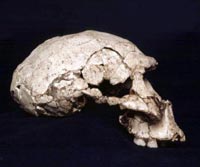
Noticias | Naturales | Evoluci�nConfirman que la evolución es irreversibleUn equipo de investigación de la Universidad de Oregon, ha constatado en laboratorio y, por primera vez, a nivel molecular, que la evolución no puede ser un proceso reversible. Según sus descubrimientos, aquellos cambios que se dan una vez en los genes de un ancestro no se invertirán nunca. Publicado: Lunes, 28/9/2009 - 23:1 | 1437 visitas.
La reversibilidad de los procesos evolutivos ha fascinado durante mucho tiempo a los biólogos, explican los investigadores en un artículo aparecido en la revista Nature, sin embargo la mayoría de las investigaciones realizadas al respecto hasta la fecha no han sido determinantes, por la falta de un método del todo fiable de estudio de genes ancestrales. Para superar este escollo, los investigadores de la Universidad de Oregon analizaron la cuestión a nivel molecular, utilizando una combinación de técnicas: reconstrucción informática de secuencias de genes ancestrales, ADN de síntesis, ingeniería de proteínas y cristalografía de rayos X. Con todas ellas, consiguieron “resucitar” un gen para una hormona-receptor, idéntico al de un ancestro vertebrado que existió hace más de 400 millones de años. Mutaciones sin marcha atrás Así, los científicos descubrieron que, en un rápido periodo de tiempo, se produjeron cinco mutaciones aleatorias en el gen reproducido, y que estas mutaciones a su vez provocaron modificaciones en la estructura de la proteína que dicho gen sintetizaba. El resultado fue que esta proteína pasó a ser incompatible con la forma original de la hormona-receptor. Según se explica en un comunicado de la Universidad de Oregón, la proteína estudiada fue la denominada receptor glucocorticoide (GR), que sujeta a la hormona cortisona y regula la respuesta al estrés, la inmunidad, el metabolismo y el comportamiento, en humanos y en otros vertebrados. Según declara Joe Thornton, uno de los autores del estudio y profesor del Centro de Ecología y de Biología Evolutiva de dicha Universidad, esta “fascinante investigación pone de relieve el valor del estudio de los procesos evolutivos”. Los especialistas afirman que demostrar cómo las estructuras moleculares son reajustadas o sincronizadas refinadamente por los procesos evolutivos, tendrá un gran impacto en las ciencias básicas y en las ciencias aplicadas, incluyendo el sector del diseño de medicamentos para proteínas específicas. En un trabajo anterior, Thornton y sus colaboradores demostraron que la primera proteína GR había evolucionado, hace más de 400 millones de años, de una proteína ancestral también relacionada con una hormona: la aldosterona. Entonces, los científicos identificaron siete mutaciones antiguas que ocasionaron que el receptor evolucionara, relacionándose posteriormente con la hormona cortisona. Una vez identificada estas siete mutaciones, los científicos quisieron averiguar si éstas eran reversibles, y “resucitaron” la proteína GR para intentar revertir en ella los cambios, mediante la manipulación de su secuencia de ADN. Los investigadores esperaban llegar así a la anterior versión de la proteína, pero en lugar de eso sólo consiguieron una proteína completamente “muerta”, no funcional. Para identificar las mutaciones, los investigadores trabajaron con cristales de las proteínas antiguas resucitadas, y los metieron en el acelerador masivo de partículas del Advanced Photon Source de Chicago. Allí, utilizando potentes rayos X determinaron la estructura atómica de la proteína, antes y después de los cambios. Así, descubrieron que las mutaciones de la versión posterior de la GR no podían coincidir con la arquitectura de la proteína inicial.
| NoticiasImágenes
Videos
Artículos
EntradasLibros
| ||||||||||||||||||||||||||||||||||||||||||||||||||

 Imagen: Ecuador Ciencia
Imagen: Ecuador Ciencia