El conocimiento detallado de los mecanismos que regulan la afinidad de la hemoglobina es imprescindible para entender, entre otras cosas, los efectos que causan las mutaciones de esta proteína. Pues bien, éste es el paso que ha dado un equipo de investigadores españoles liderado por Víctor Guallar, del departamento de Ciencias de la Vida del Barcelona Supercomputing Center (BSC) y del Programa Conjunto de Biología Computacional del Instituto de Investigación Biomédica (IRB Barcelona). La investigación, elegida portada de la revista Proceedings of the National Academy of Sciences (PNAS), ha permitido definir, a nivel atómico, el mecanismo que regula el intercambio de oxígeno del pulmón a la hemoglobina y de ésta al tejido.
"La hemoglobina es una proteína que se presenta en dos geometrías diferentes, una que está cargada de oxígeno y la otra está totalmente descargada; para pasar de una a otra dispone de un mecanismo de cooperatividad en las cuatro cadenas o posiciones en las que puede lanzar oxígeno", explica Guallar. En este sentido, este equipo de investigadores han caracterizado la afinidad de estas estructuras, es decir, el motivo por el que unas lanzan más oxígeno que otras. "Hemos caracterizado las estructuras R y P que son los extremos, uno de ellos enlazado con el oxígeno y el otro no. El mecanismo o los elementos principales de la proteína que gobiernan esta afinidad son los mismos que cambian de una estructura a otra, los mismos que están involucrados en el cambio de cooperatividad", dice este investigador. Para Guallar este hallazgo abre muchas puertas al entendimiento tanto del mecanismo de cooperatividad como de los elementos que regulan esta afinidad de la proteína.
La afinidad por el oxígeno parece estar controlada por interacciones relativamente alejadas del centro activo de la proteína que están directamente involucradas en cambios estructurales responsables de la cooperatividad. Según este investigador, hay algunas anemias que mutan un regido de una de las cadenas de hemoglobina lo que provoca una disminución de la afinidad. "Si entendemos los elementos que regulan la afinidad podremos hacer ingeniería en la proteína y fabricar estructuras que tengan más afinidad. Del mismo modo, podremos entender las mutaciones que provocan las anemias dentro de la hemoglobina y crear, así, un tratamiento contra ellas", señala este investigador.
El objetivo, en este sentido, es ver cuáles son las consecuencias de tipo patológico que tienen estas mutaciones con el fin de diseñar fármacos que bloqueen este efecto. "Queremos entender cómo funcionan estos mecanismos a nivel atómico. Ahora llegamos a un nivel de precisión mucho más exacto. Hace unos años no podíamos hacer estos cálculos; lo que podremos hacer dentro de 10 ó 15 años será espectacular", concluye este investigador.
Noticia publicada en Gaceta Médica (España)








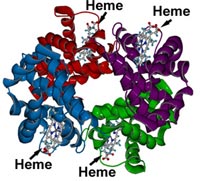
 Imagen: Agencias / Internet
Imagen: Agencias / Internet




